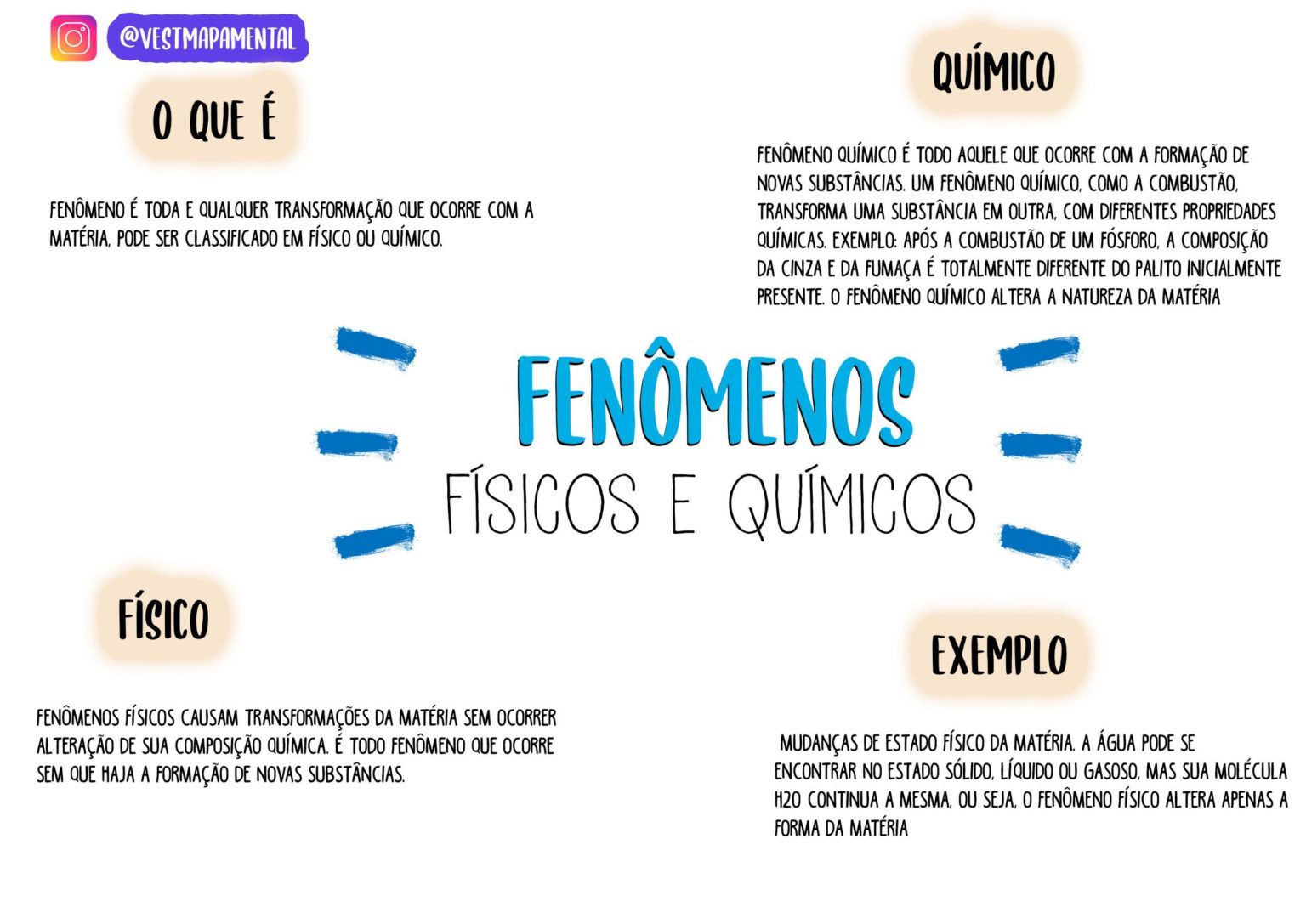
Transformações Da Matéria – Fenômenos Físicos E Fenômenos Químicos: A matéria está em constante mudança, ora sutilmente, ora de forma dramática. Compreender essas transformações é fundamental para desvendar os segredos do universo que nos cerca. Neste texto, vamos explorar a diferença crucial entre fenômenos físicos, que alteram a forma mas não a composição da matéria, e fenômenos químicos, que resultam em novas substâncias com propriedades distintas.
De mudanças de estado físico à combustão, da ferrugem à digestão, vamos mergulhar no fascinante mundo das transformações da matéria, analisando reações exotérmicas e endotérmicas, e desvendando os aspectos microscópicos que governam essas mudanças.
A jornada pela compreensão das transformações da matéria nos levará a uma exploração das ligações químicas, da conservação da massa e da importância dessas reações em processos vitais como a fotossíntese e a respiração celular. Prepare-se para uma viagem pelo microcosmo, onde átomos se unem e se separam, moldando o mundo macroscópico que percebemos.
Diferenciando Fenômenos Físicos e Químicos
A compreensão da diferença entre fenômenos físicos e químicos é fundamental para a interpretação das transformações que a matéria sofre. Fenômenos físicos envolvem mudanças na aparência ou estado físico da matéria, sem alterar sua composição química. Já os fenômenos químicos resultam em mudanças na composição da matéria, formando novas substâncias com propriedades diferentes. A distinção entre esses dois tipos de fenômenos é crucial para diversas áreas, desde a química e a física até a engenharia e a medicina.
Exemplos de Fenômenos Físicos
A seguir, apresentamos três exemplos de fenômenos físicos, onde a matéria sofre transformações sem alterar sua composição química. Observar as mudanças de estado físico, a deformação e a dissolução são exemplos clássicos de como a matéria pode se transformar sem que sua identidade química seja comprometida.
| Substância | Transformação | Observações | Tipo de Fenômeno |
|---|---|---|---|
| Água | Fusão (derretimento do gelo) | O gelo, sólido, transforma-se em água líquida, mantendo a composição química (H₂O). Observa-se mudança de estado físico, com alteração na forma e na temperatura. | Físico |
| Borracha | Deformação | Uma borracha pode ser esticada e comprimida, alterando sua forma e tamanho. Após a cessação da força aplicada, ela tende a retornar ao seu formato original, sem alteração em sua composição. | Físico |
| Açúcar | Dissolução em água | O açúcar se dissolve na água, formando uma solução homogênea. Embora aparentemente desapareça, o açúcar continua quimicamente inalterado, podendo ser recuperado por evaporação da água. | Físico |
Comparação entre Mudança de Estado Físico da Água e Reação Química de Combustão
A mudança de estado físico da água, como a passagem do estado sólido (gelo) para o líquido (água) e para o gasoso (vapor), ilustra um fenômeno físico. A composição química da água (H₂O) permanece inalterada durante todo o processo. Já a combustão, por exemplo, a queima de um pedaço de madeira, é um fenômeno químico. A madeira, composta por diversas substâncias orgânicas, reage com o oxigênio do ar, produzindo dióxido de carbono (CO₂), água (H₂O) e cinzas, substâncias com composição química diferente da madeira original.
Portanto, a principal diferença reside na alteração ou não da composição química da matéria envolvida. No caso da água, apenas o estado físico muda, enquanto na combustão, novas substâncias são formadas.
Fluxograma Diferenciando Fenômenos Físicos Reversíveis e Irreversíveis
A reversibilidade de um fenômeno físico é um critério importante para sua classificação. Um fenômeno físico reversível pode ser desfeito, retornando a matéria às suas condições iniciais. Já um fenômeno físico irreversível resulta em alterações permanentes na matéria.
Um fenômeno físico é reversível se o processo pode ser invertido, retornando a matéria ao seu estado original. Caso contrário, é irreversível.
O fluxograma a seguir ilustra a diferenciação:(Infelizmente, não posso criar imagens ou fluxogramas diretamente. Imagine um fluxograma com um ponto de decisão inicial: “Fenômeno Físico?”. Se sim, a próxima pergunta seria: “Reversível?”. Se sim, exemplos como o derretimento e congelamento da água são mostrados. Se não, exemplos como a quebra de um copo de vidro são mostrados.
)
Exemplos de Transformações Químicas na Vida Diária: Transformações Da Matéria – Fenômenos Físicos E Fenômenos Químicos
As transformações químicas, também conhecidas como reações químicas, estão presentes em nosso cotidiano de forma constante, muitas vezes de maneira imperceptível. Compreender esses processos é fundamental para entender o mundo ao nosso redor, desde a digestão dos alimentos até a produção de energia. Nesta seção, exploraremos alguns exemplos concretos dessas transformações, analisando os reagentes, produtos e as mudanças observadas.
Reações Químicas Comuns no Dia a Dia
A seguir, detalhamos três reações químicas facilmente observáveis no cotidiano: a formação de ferrugem, a queima de madeira e a digestão dos alimentos. A análise dessas reações permitirá uma melhor compreensão dos conceitos de reagentes, produtos e as mudanças físicas e químicas envolvidas.
- Formação de Ferrugem:
- Reagentes: Ferro (Fe) e Oxigênio (O 2) da atmosfera, na presença de água (H 2O).
- Produtos: Óxido de ferro hidratado (Fe 2O 3·xH 2O), também conhecido como ferrugem.
- Mudanças Observadas: A superfície do ferro metálico adquire uma coloração avermelhada e textura porosa, indicando a formação de um novo composto químico. O processo é lento e progressivo, causando deterioração do material.
- Queima de Madeira:
- Reagentes: Madeira (celulose, lignina e outros compostos orgânicos) e Oxigênio (O 2).
- Produtos: Dióxido de carbono (CO 2), água (H 2O), cinzas (resíduos minerais) e energia térmica.
- Mudanças Observadas: A madeira se transforma em cinzas, liberando calor, fumaça (contendo partículas de carbono e outros compostos) e gases. Há uma mudança significativa na estrutura e composição da matéria.
- Digestão dos Alimentos:
- Reagentes: Alimentos (carboidratos, proteínas, lipídios) e enzimas digestivas.
- Produtos: Moléculas menores (açúcares simples, aminoácidos, ácidos graxos e glicerol) e energia química (ATP).
- Mudanças Observadas: Os alimentos sofrem quebra de suas moléculas complexas em moléculas menores, absorvíveis pelo organismo. Este processo é essencial para a obtenção de energia e nutrientes.
Reações Exotérmicas e Endotérmicas
A classificação das reações químicas como exotérmicas ou endotérmicas depende da troca de calor com o ambiente. Reações exotérmicas liberam calor para o meio, enquanto as endotérmicas absorvem calor do meio. A seguir, exemplos de cada tipo:
- Reações Exotérmicas (liberam calor):
- Combustão: Queima de combustíveis como gasolina, gás natural e madeira. Liberação de energia térmica e luminosa.
- Respiração Celular: Processo metabólico que quebra moléculas orgânicas para gerar energia (ATP) e calor.
- Neutralização Ácido-Base: Reação entre um ácido e uma base, liberando calor e formando sal e água.
- Explosão: Reação química rápida e violenta que libera grande quantidade de energia na forma de calor, luz e som.
- Reação de Oxidação: Reações como a formação de ferrugem, que liberam calor durante o processo de oxidação.
- Reações Endotérmicas (absorvem calor):
- Fotossíntese: As plantas absorvem energia luminosa para converter dióxido de carbono e água em glicose e oxigênio.
- Dissolução de alguns sais: A dissolução de alguns sais em água absorve calor do ambiente, resultando em um abaixamento da temperatura.
- Decomposição do Carbonato de Cálcio: A decomposição do carbonato de cálcio (calcário) em óxido de cálcio e dióxido de carbono requer a absorção de calor.
- Fusão do Gelo: A transformação da água sólida (gelo) em água líquida requer absorção de calor.
- Evaporação da Água: A transformação da água líquida em vapor requer absorção de calor.
A Importância das Reações Químicas na Produção de Energia
As reações químicas são fundamentais para a produção de energia em diversos sistemas, tanto em escala macroscópica quanto microscópica. A fotossíntese e a respiração celular são exemplos primordiais desse processo. A fotossíntese, realizada pelas plantas e algas, converte energia luminosa em energia química na forma de glicose, armazenando-a como fonte de alimento. Já a respiração celular é o processo inverso, onde a glicose é quebrada, liberando a energia química armazenada na forma de ATP (adenosina trifosfato), a principal moeda energética das células.
Sem essas reações, a vida na Terra como a conhecemos seria impossível. Além dessas, outras reações químicas, como a combustão de combustíveis fósseis, são utilizadas para gerar energia elétrica em larga escala, embora com impactos ambientais significativos.
Aspectos Microscópicos das Transformações da Matéria
A compreensão das transformações da matéria requer uma análise em nível microscópico, focando nas mudanças estruturais que ocorrem em nível atômico e molecular. Observar o rearranjo dos átomos e moléculas durante reações químicas é fundamental para elucidar os fenômenos físicos e químicos. Esta seção explorará esses aspectos, utilizando exemplos concretos para ilustrar os conceitos.
Mudanças na Estrutura Molecular Durante Reações Químicas

A formação da água a partir da reação entre hidrogênio e oxigênio é um exemplo clássico de transformação química que demonstra mudanças significativas na estrutura molecular. Inicialmente, temos moléculas diatômicas de hidrogênio (H₂) e oxigênio (O₂), onde átomos do mesmo elemento estão unidos por ligações covalentes. Durante a reação, essas ligações são rompidas, e os átomos se rearranjam para formar moléculas de água (H₂O), com ligações covalentes entre átomos de hidrogênio e oxigênio.O desenho esquemático a seguir ilustra essa transformação:Antes da reação: H-H + O=ODepois da reação: H-O-H + H-O-HObserve que as ligações entre os átomos de hidrogênio e entre os átomos de oxigênio são quebradas, enquanto novas ligações são formadas entre átomos de hidrogênio e oxigênio.
Essa reorganização atômica resulta na formação de uma nova substância com propriedades distintas das substâncias reagentes.
Conservação da Massa em Reações Químicas, Transformações Da Matéria – Fenômenos Físicos E Fenômenos Químicos
A lei da conservação da massa afirma que, em uma reação química, a massa total dos reagentes é igual à massa total dos produtos. Isso significa que, embora os átomos se rearranjem para formar novas moléculas, o número total de átomos de cada elemento permanece constante. Na formação da água, por exemplo, dois átomos de hidrogênio e um átomo de oxigênio se combinam para formar uma molécula de água.
Se começarmos com 2 gramas de hidrogênio e 16 gramas de oxigênio, obteremos 18 gramas de água, demonstrando a conservação da massa. A massa não é criada nem destruída, apenas transformada.
Comparação de Ligações Químicas em Compostos Iônicos e Covalentes
As ligações químicas são as forças que unem os átomos para formar moléculas ou compostos iônicos. Existem diferentes tipos de ligações químicas, sendo as ligações iônicas e covalentes as mais comuns.
Em ligações iônicas, ocorre a transferência de elétrons de um átomo para outro, resultando na formação de íons com cargas opostas que se atraem eletrostaticamente. Essa atração forma um composto iônico, como o cloreto de sódio (NaCl), onde o sódio (Na) doa um elétron para o cloro (Cl).
Já em ligações covalentes, os átomos compartilham elétrons para atingir a estabilidade eletrônica. A água (H₂O) é um exemplo de composto com ligações covalentes, onde os átomos de hidrogênio compartilham elétrons com o átomo de oxigênio.
As diferenças nas ligações iônicas e covalentes resultam em propriedades físicas e químicas distintas. Compostos iônicos, geralmente, apresentam altos pontos de fusão e ebulição, são sólidos cristalinos e conduzem eletricidade quando dissolvidos em água. Compostos covalentes, por outro lado, podem existir como sólidos, líquidos ou gases, e têm pontos de fusão e ebulição mais baixos, com menor condutividade elétrica.
Essas diferenças são consequência direta da natureza das forças interatômicas envolvidas.
Em resumo, a distinção entre fenômenos físicos e químicos reside na alteração ou não da composição da matéria. Fenômenos físicos, como mudanças de estado, são reversíveis em muitos casos, enquanto fenômenos químicos, como reações de combustão, geram novas substâncias com propriedades diferentes. A compreensão desses processos, desde o nível macroscópico até a interação de átomos e moléculas, é essencial para avançar em diversas áreas da ciência e tecnologia.
De processos industriais à biologia celular, as transformações da matéria são a base de tudo o que nos rodeia.


